Glioma: o que é, causas, sintomas, tratamento, prognóstico
Contente
- O que é glioma?
- Classificação
- sinais e sintomas
- Previsão
- Causas e fatores de risco
- Populações afetadas
- Diagnóstico
- Tratamentos padrão
O que é glioma?
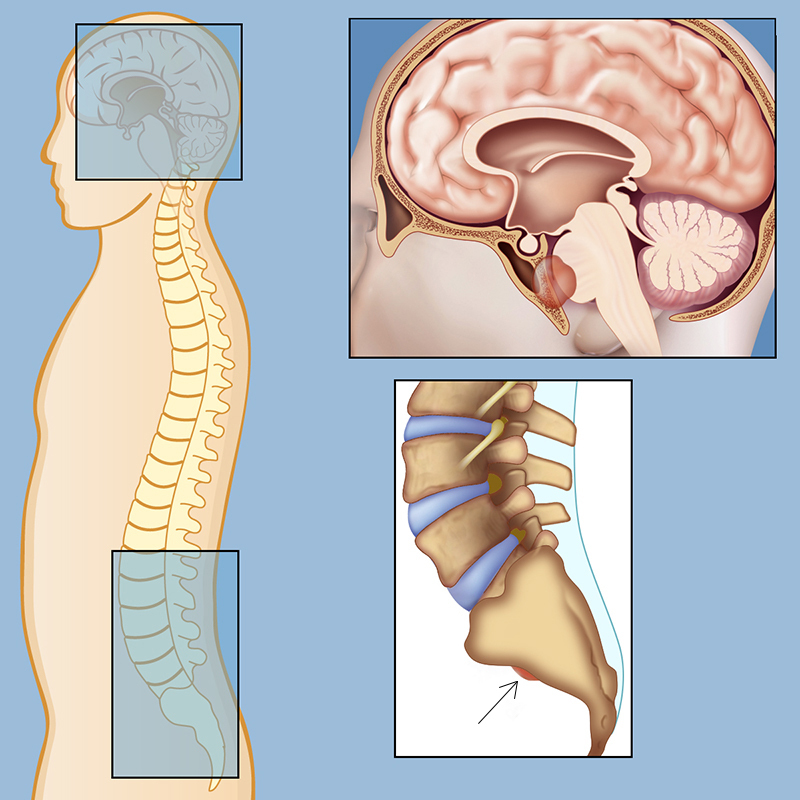
Glioma É um tumor do sistema nervoso central que surge a partir de células-tronco gliais ou células progenitoras. As células gliais são um tipo de célula abundante no sistema nervoso. Os gliomas são encontrados principalmente no cérebro e, raramente, na medula espinhal. Os tumores se desenvolvem em cerca de 6,6 casos por 100.000 pessoas por ano. Eles ocorrem em diferentes idades, dependendo do subtipo.
O desenvolvimento de gliomas pode comprimir as áreas do cérebro onde ocorrem e causar uma variedade de sintomas, incluindo dores de cabeça, náuseas, vômitos, comprometimento cognitivo, convulsões, desequilíbrio da marcha, distúrbio da língua (afasia), dormência ou fraqueza em um lado do corpo (hemiparesia), alterações na visão e personalidade.
O tratamento para gliomas geralmente requer uma combinação de neurocirurgia, radioterapia e quimioterapia.
Classificação
A classificação dos gliomas é complexa e é baseada em parte na aparência microscópica do tumor (classificação histológica) e em parte nas alterações genéticas (mutações) que estão associadas ao desenvolvimento do tumor. A diferenciação é um conceito importante na classificação histológica dos gliomas e refere-se à "especialização" da célula. Por exemplo, algumas células cerebrais podem apresentar diferenciação neuronal ou glial, enquanto as células-tronco embrionárias não se diferenciam. A classificação histológica dos gliomas depende da semelhança microscópica das células tumorais com diferentes subtipos de células gliais (como astrócitos e células ependimárias), o crescimento e o comportamento do tumor e o grau de diferenciação celular no tumor (grau).
Os gliomas podem ter quatro graus diferentes de diferenciação. Os gliomas de grau 1 mostram o nível mais alto de diferenciação e são os menos malignos, enquanto os tumores de grau 4 são os menos diferenciados e mais malignos. A perda de diferenciação é conhecida como anaplasia, daí o nome de vários gliomas de grau 3. Os gliomas de grau 1 e 2 são freqüentemente chamados de gliomas de baixo grau, e os gliomas de grau 3 e 4 são freqüentemente chamados de gliomas malignos. Uma classificação posterior é possível dependendo das mudanças genéticas que ocorreram nas células afetadas. Os 5 tipos de gliomas são discutidos abaixo.
- Gliomas difusos.
Os gliomas difusos são de longe os tumores gliais mais comuns em adultos. Eles crescem difusamente e penetram nos tecidos funcionais do sistema nervoso central (parênquima do SNC). Eles podem ser subdivididos de acordo com o tipo de célula glial da qual surgem: tumores astrocíticos surgem dos astrócitos, um tipo de célula glial que está envolvida na manutenção dos neurônios, no processo de reparo dos tecidos do cérebro e da medula espinhal e na formação da barreira hematoencefálica. Tumores astrocíticos difusos adicionalmente caracterizado por terem mutações em IDH1 ou IDH2, que são genes envolvidos no metabolismo celular. Eles também podem ter mutações em genes como a proteína 53 do tumor (TP53, o principal gene supressor de tumor) e o gene ATRXenvolvido na remodelação da cromatina, um complexo de DNA-RNA-proteína. Glioblastoma é o subtipo mais comum e maligno de glioma difuso. Glioma difuso da linha média É outro tipo de glioma astrocítico maligno (grau IV) associado à mutação H3-K27M. Essa mutação afeta as histonas, que fazem parte de um complexo de proteínas envolvidas no dobramento do DNA dentro da célula.
Olidendrogliomas surgem de oligodendrócitos, que são responsáveis pela formação da bainha de mielina dos neurônios do sistema nervoso central. A bainha de mielina isola o axônio, o "cabo" por onde passa a corrente elétrica gerada pelo neurônio. Mutações IHD1 e IDH2 também característico de tumores oligodendrogliais difusos. A remoção do braço curto do cromossomo 1 (1p) e do braço longo do cromossomo 19 (19q), conhecida como remoção articular de 1p / 19q, também é uma característica desses tumores gliais. Transcriptase reversa da telomerase (TERT) gene codifica uma importante subunidade da telomerase. Os telômeros estão localizados no final do cromossomo e encurtam a cada divisão celular. A telomerase é uma proteína que pode alongar os telômeros. Mutações na região promotora TERT pode estar presente em oligodendrogliomas difusos e levar à superexpressão da telomerase, que pode levar ao alongamento descontrolado dos telômeros e potencial de replicação infinita no tumor células.
- Outros tumores astrocíticos.
Como a maioria dos outros gliomas não difusos, outros tumores astrocíticos tendem a crescer lentamente e são considerados mais encapsulados. Eles são mais comumente vistos em crianças e adultos jovens. Os tumores conhecidos nesta categoria incluem astrocitoma pilocítico (grau I) e astrocitoma de células gigantes subependimárias. Astrocitomas pilocíticos são os gliomas infantis mais comuns e estão associados a inúmeras anormalidades genéticas, a mais comum das quais é a fusão gênica KIAA1549 e BRAF. Isso leva à superexpressão do gene BRAFo que, por sua vez, leva ao crescimento celular desregulado. Astrocitomas de células gigantes subependimárias estão intimamente relacionados a uma síndrome conhecida como esclerose tuberosa, e, portanto, estão associados a mutações nos genes do complexo da esclerose tuberosa tipos 1 e 2 (TSC1 e TSC2).
— Ependymaltumores.
Os tumores ependimários surgem de células ependimárias que revestem uma área do cérebro conhecida como sistema ventricular, onde o líquido cefalorraquidiano (LCR) é criado e circulado. O LCR tem muitas funções, incluindo a transferência de nutrientes de e para o cérebro e a proteção contra lesões por choque. Os subtipos mais comuns de tumores ependimários são ependimoma de baixo grau (grau II) e ependimoma anaplásico (grau III). As anormalidades genéticas presentes dependem do subtipo e da localização do tumor. Por exemplo, os tumores ependimários de grau II e III localizados acima do cerebelo (tumores supratentorial) estão associados à fusão gênica RELA e C11orf95. Essa fusão gênica leva à ativação de muitos outros genes e contribui para a formação de tumores ependimários.
- Outros gliomas.
Os tumores gliais nesta categoria podem mostrar sinais de outros tipos de gliomas, mas com suas próprias características únicas que variam por subtipo. Na maioria dos pacientes, eles crescem lentamente e bem definidos.
- Tumores neuronal-gliais mistos.
Como o nome sugere, os tumores neuronal-gliais mistos contêm células de diferenciação glial e neuronal. O diagnóstico desses tumores pode ser desafiador, pois eles podem ser confundidos com gliomas difusos que circundam os neurônios. Como regra, os tumores neuronal-gliais mistos são bem definidos e de crescimento lento. Eles também mostram perfis moleculares claros. Por exemplo, tumores glioneuronais leptomeníngeos difusos não têm mutações IDH1mas geralmente tem mutações BRAF e deleções do braço curto do cromossomo 1 (1p) com ou sem deleções associadas do braço longo do cromossomo 19 (19q).
sinais e sintomas

Os sintomas associados aos gliomas são iguais para todos os tipos, mas podem variar dependendo do paciente e da localização do tumor. Ataques epilépticos (focal ou generalizado), distúrbio da língua (afasia), fraqueza em uma parte do corpo (hemiparesia), alterações sensoriais em uma parte do corpo e dores de cabeça são sinais comuns da doença. Outros sintomas possíveis incluem:
- distúrbios da marcha;
- fadiga;
- tontura;
- mudanças visuais;
- vômito;
- mudanças na micção.
Também podem ocorrer sintomas psicológicos, como:
- comprometimento cognitivo;
- mudanças de personalidade;
- depressão;
- ansiedade;
- comprometimento da memória.
A maioria dos sintomas se deve à ação compressiva do tumor e do fluido circundante (edema peritumoral) no cérebro. Os gliomas malignos (graus 3 e 4) também estão associados ao desenvolvimento de coágulos sanguíneos nas veias profundas, especialmente nas pernas (trombose venosa profunda das extremidades inferiores), que pode se deslocar e migrar, bloqueando as artérias dos pulmões (tromboembolismo pulmonar).
Os gliomas podem se desenvolver em qualquer idade. A idade média em que ocorrem varia muito, dependendo do subtipo de glioma. Por exemplo, metade dos astrocitomas pilocíticos ocorrem em crianças com menos de 12 anos e metade dos glioblastomas ocorrem em pessoas com mais de 65 anos. O mesmo caminho, sobrevivência altamente dependente do subtipo de glioma. O astrocitoma pilocítico tem sobrevida de 96,9% após 5 anos em crianças menores de 14 anos, enquanto em adultos com mais de 40 anos com glioblastoma esse valor é de 4,3%.
Previsão
Além de ser usado para diagnóstico e classificação, as mutações genéticas presentes nas células afetadas também são usadas para prever curso e sobrevivência da doença (prognóstico). Por exemplo, mutações no gene IDH1 associado a uma maior taxa de sobrevida em 5 anos para glioblastoma e outros gliomas difusos. Mudanças que não afetam diretamente o código genético, mas sim a forma como ele é lido e expresso (modificações epigenéticas), também desempenham um papel no prognóstico. Um exemplo de uma mudança epigenética é um gene de reparo de DNA chamado MGMT. Quando esse gene está ativo, ele pode reparar o DNA danificado das células tumorais, promovendo sua sobrevivência e tornando-as mais resistentes a certos tratamentos. No entanto, se este gene for silenciado por modificações químicas específicas (chamadas de metilação das ilhotas CpG), é incapaz de reparar danos ao DNA, tornando-o mais suscetível a certos tratamento. Silêncio epigenético MGMT (via metilação do promotor) é observada em cerca de 40% dos pacientes com glioblastoma e está associada a melhor sobrevida e maior resposta ao tratamento.
Com o tempo, os gliomas podem aumentar de grau e, portanto, tornar-se mais malignos (progressão maligna). A taxa de progressão maligna depende do subtipo de glioma e das características genéticas das células afetadas. Níveis mais altos de tumores geralmente estão associados a taxas de sobrevivência mais baixas.
Causas e fatores de risco
Os gliomas são causados pelo acúmulo de mutações genéticas no tronco glial ou nas células progenitoras, fazendo com que cresçam descontroladamente. Genes mutantes estão comumente envolvidos em funções como supressão de tumor, reparo de DNA e regulação do crescimento celular. Exemplos de genes mutados em certos tipos de glioma incluem TP53, PTEN (genes supressores de tumor), ATRX (envolvido na remodelação da cromatina, complexo DNA-RNA-proteína), TERT (que codifica uma subunidade da telomerase, uma enzima que pode levar a um potencial de fissão infinito nas células) BRAF (envolvida no crescimento celular) e IDH1 (envolvido no metabolismo celular).
A causa subjacente exata do desenvolvimento de glioma na grande maioria das pessoas é desconhecida. O único fator de risco identificado para o meio ambiente, associada aos gliomas, está a exposição à radiação ionizante. Os gliomas malignos podem ocorrer por conta própria (mutação de novo), ou pode resultar de maior acúmulo de mutações genéticas em gliomas de baixo grau (progressão maligna). As células malignas de glioma geralmente perdem sua estrutura e função especializadas (desdiferenciação ou anaplasia). Inicialmente, todas as células de um glioma contêm o mesmo código genético e são idênticas. Com o tempo, diferentes mutações se acumulam em diferentes células tumorais, resultando em diferentes subclones e um tumor geneticamente heterogêneo. Mudanças que não afetam diretamente o código genético, mas sim como ele é lido e expresso (modificações epigenéticas), também estão envolvidas no crescimento e desenvolvimento dos gliomas.
As células em gliomas alteraram o metabolismo da glicose (o uso predominante da glicólise aeróbica, conhecido como efeito Warburg) e são capazes de desenvolver sua própria rede de vasos sanguíneos (angiogênese), o que lhes permite manter altas necessidades de energia para divisão e crescimento células. Inflamação e acúmulo de líquido ao redor do tumor (edema peritumoral) também são sinais de glioma. Com o tempo, certos tipos de gliomas podem crescer e invadir o tecido cerebral saudável.
Populações afetadas
Excluindo as metástases de outros cânceres que afetam o sistema nervoso central, os gliomas são responsáveis por 26% de todos tumores cerebrais (tumores cerebrais primários) e 81% de todos os tumores cerebrais malignos. Eles se desenvolvem em cerca de 6,6 por 100.000 pessoas por ano e 2,94 por 100.000 pessoas com menos de 14 anos. A idade média (ou seja, metade dos indivíduos afetados é mais jovem do que essa idade e a outra metade é mais velha) para o desenvolvimento de glioma é de 12 a 65 anos, dependendo do subtipo. Astrocitoma pilocítico é o glioma mais comum em pessoas com menos de 14 anos (34,4% de todos os gliomas), enquanto o glioblastoma é o glioma adulto mais comum (56,6% de todos gliomas).
Os gliomas são ligeiramente mais comuns em homens. Eles tendem a afetar pessoas mais velhas e são mais comuns em países com maiores níveis de desenvolvimento, pois esses países tendem a ter uma proporção maior de pessoas idosas. Existem também várias síndromes associadas a um maior risco de desenvolver glioma.
Diagnóstico
O diagnóstico de glioma requer uma história extensa do paciente, bem como um exame físico e neurológico completo. Os sinais de que uma investigação mais aprofundada pode ser necessária incluem novas convulsões, declínio cognitivo grave e outros sintomas neurológicos. Dores de cabeça que aparecem ou pioram repentinamente, que começam a ocorrer após os 50 anos, despertando o paciente do sono mesmo em leves, e que estão associados a funções cognitivas prejudicadas, são sinais de alerta que indicam a presença de um tumor em cérebro.
A presença de um tumor cerebral pode ser suspeitada por imagens médicas. A ressonância magnética (MRI) é a técnica de imagem preferida para a avaliação inicial do glioma. O diagnóstico final e, portanto, o plano de tratamento só podem ser determinados após a análise microscópica de um pedaço de tecido tumoral. Uma avaliação adicional pode ser realizada testando o DNA das células afetadas para determinar a presença de mutações em genes associados a certos subtipos de glioma.
A idade do paciente, os sintomas clínicos, os achados de imagem e a análise patológica ajudam a determinar as melhores opções de tratamento e prognóstico para o paciente.
Tratamentos padrão
O manejo terapêutico de pacientes com gliomas requer uma grande equipe multidisciplinar de profissionais médicos e profissionais de saúde. Os pacientes geralmente vão ao pronto-socorro ou são encaminhados pelo médico responsável para exames de ressonância magnética. Uma ressonância magnética do cérebro do paciente será interpretada por um radiologista ou neurorradiologista. Depois de feito um diagnóstico inicial, o paciente será considerado para a neurocirurgia para remover com segurança o máximo possível do tumor (ressecção cirúrgica). O ácido 5-aminolevulínico (5-ALA) é um medicamento que pode ser prescrito durante a cirurgia, em como resultado do qual as células tumorais, especialmente as malignas, tornam-se fluorescentes e melhoram o grau de ressecção. Após a cirurgia, um neurologista examinará e caracterizará o tumor ao microscópio.
O manejo terapêutico depende do tipo de glioma, de seu tamanho e localização, e das características específicas do paciente. Especialmente em pacientes nos quais o tumor não pode ser completamente removido porque invade o cérebro em áreas críticas ou é inacessível, a operação será seguida de quimioterapia e radioterapia. Portanto, a colaboração de oncologistas de radiação e oncologistas médicos ou neuro-oncologistas será necessária. Exemplos de quimioterapia para glioma incluem temozolomida e lomustina. Esses dois medicamentos fazem parte de uma classe de medicamentos conhecidos como agentes alquilantes. Seu efeito terapêutico é danificar o DNA das células tumorais, o que leva à morte das células tumorais. Os gliomas bem circunscritos só podem ser tratados com ressecção cirúrgica.
Além da quimioterapia, os medicamentos administrados a pessoas com gliomas podem incluir medicamentos antiepilépticos (se o paciente tiver epilepsia), anticoagulantes (se houver formação de coágulos sanguíneos) e corticosteroides para aliviar os sintomas neurológicos causados pelo acúmulo de líquido ao redor do tumor (edema peritumoral). Neurologistas e possivelmente outros profissionais médicos podem ser obrigados a escrever prescrições e acompanhar os indivíduos afetados.
Os pacientes podem precisar passar por reabilitação após a cirurgia para recuperar as funções afetadas pelo tumor e pela cirurgia. As equipes de reabilitação incluem muitos profissionais de saúde, incluindo fisioterapeutas, terapeutas ocupacionais e enfermeiras. Infelizmente, como alguns subtipos de gliomas são muito agressivos, os pacientes que os sofrem podem ser forçados a se submeter a terapia paliativa, onde eles receberão o tratamento ideal para minimizar os sintomas e a dor, incluindo analgésicos, medicamentos antiepilépticos e antieméticos fundos.